専門分野
生物物理
生命のしくみを物理の言葉で理解する
研究テーマ
生命システムの後天的獲得情報の処理機構の理解/ 構成的手法を用いた細胞ネットワークシステムの協同性、集団効果の理解(心筋細胞・神経細胞ネットワークなど) / 免疫細胞の自他認識、標識部位抽出能力等の情報処理の解明 / 転移がん機構の解明 / 細胞チップを用いた創薬支援技術の開発 / イメージングセルソーター技術によるイメージングバイオマーカーの探索 / 超音波輻射圧の物性の研究
キーワード
生命情報処理機構, エピジェネティクス, 細胞ネットワーク, 協同性・集団効果, 心筋細胞/神経細胞, 自他認識, 標識部位抽出, 免疫情報処理, 転移がん, 創薬支援, 細胞チップ, イメージングバイオマーカー探索. イメージングセルソーター, 超音波輻射圧. 構成的アプローチ
LINKS
RESEARCH OVERVIEW
研究概要
生物は、分子から細胞、個体に至る階層構造を持ったシステムとして機能しています。単純な原子、分子の集合化のみでは構築できない「生命」の特徴を生み出している本質はどこにあるのでしょうか。また、この「生命」の神秘はすべて物理法則のみで記述し、説明できるのでしょうか。
物理学の世界では原子、分子が規則性を持った現象論で議論をするに十分な振る舞いを見せるためにはアボガドロ数程度の要素の集合が必要ですが、生命システムの中ではわずか数個の要素を組み合わせることで巧みに高い規則性、再現性、保存性を維持することができます。これは、まさに生命システムが持つ「集団効果」であり、これを実現するための規則性、秩序をもたらす巧みな機構が生命の本質の一つなのかもしれません。
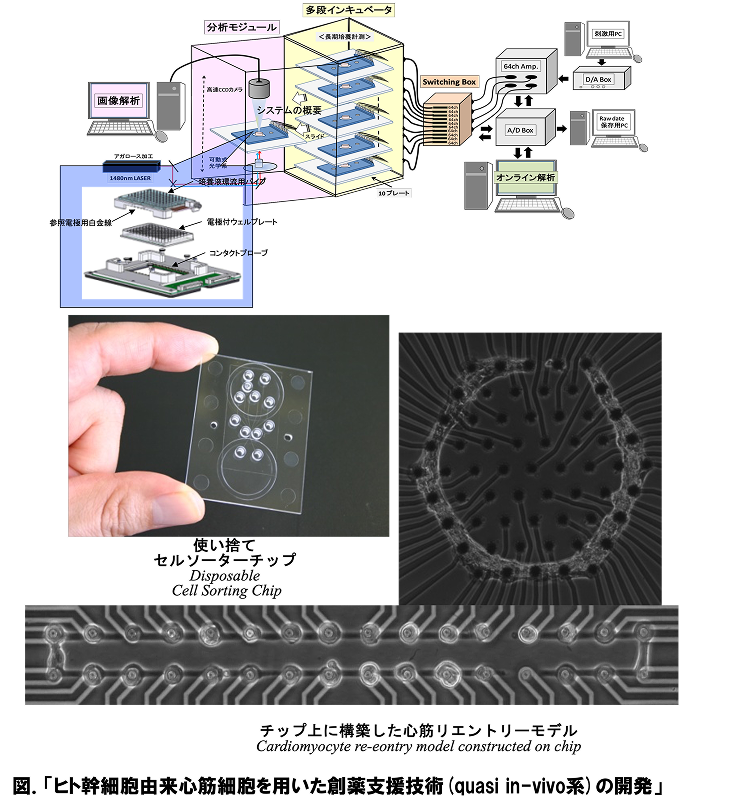
わたしたちは、この生命の各階層での要素1単位とその集団効果について、構成的な手法を用いて解明を進めています。たとえば、化学・力学エネルギー変換システムである生体分子モーターについては、その1分子の機構の解明と、これが自己組織化した筋原線維の集団的協同(振動)現象を、細胞レベルでは、心筋細胞や神経細胞1細胞の振る舞いと、これが空間配置を持って集団化したときの振る舞いの比較解析を行い、そこから「臓器モデル」ともいえる最小の細胞ネットワークチップなども構築に成功しており、創薬スクリーニングでの応用も始まりつつあります。このように、生物物理学の生物学との最大の違いは、物理法則の理解の上に立った生命現象の理解なのです。そして、生物物理学のもう一つの特徴 は、生命現象を理解するために必要手法や装置も物理学の知識を基盤とした技術から自分たちで考案して創り上げてゆくところにあります。みなさんも一緒に物理学からの生命の理解を進めてゆきましょう。
MESSAGE to STUDENTS
学生へのメッセージ
一度の人生を全力で挑戦して満喫しましょう。そして自分自身が生涯をかけて進んでゆくオンリーワンの道を進んで行きましょう。
学歴・経歴
1990年 早稲田大学・理工学部・物理学科 卒業
1992年 早稲田大学・大学院・理工学研究科・物理学及応用物理学専攻 修了
1992年-1999年 株式会社 日立製作所 基礎研究所 研究員
1999年-2006年 東京大学・大学院・総合文化研究科 助教授・教授
2006年-2016年 東京医科歯科大学・生体材料工学研究所 教授
2016年-現在 早稲田大学・理工学術院・先進理工学部・物理学科 教授
所属学協会
- 日本生物物理学会
- 日本物理学会
- 日本応用物理学会
- 米国生物物理学会
- 米国音響学会
Field of study
Biophysics
Discovering How Life Works—With Physics as Our Guide
Research Themes
Epigenetic information processing in living systems / Collective dynamics in engineered cellular networks (e.g., cardiomyocytes, neurons) / Signal recognition and target extraction in immune cells / Mechanistic studies of cancer metastasis / Cell chip technologies for drug screening / Imaging biomarker discovery via imaging cell sorters / Physical characterization of acoustic radiation pressure
Keywords
Biological information processing, Epigenetics, Cellular networks, Cooperativity and collective behavior, Cardiomyocytes / Neurons, Self/non-self recognition, Target marker extraction, Immune information processing, Metastatic cancer, Drug discovery support, Cell-based microdevices, Imaging biomarker discovery, Imaging cell sorter, Acoustic radiation pressure, Constructive approach
LINKS
RESEARCH OVERVIEW
Cells within a group may appear similar, yet even those with identical genetic information and grown under uniform conditions often respond differently to the same perturbations. These differences cannot be fully explained by genetics alone. Instead, they reflect a combination of genetic programming and epigenetic influences—factors shaped by a cell’s history of interactions, its microenvironment, and fluctuations in surrounding conditions. Understanding how such differences arise and how they are regulated requires new approaches that integrate both genetic and epigenetic perspectives.
Our research focuses on uncovering the physical basis of epigenetic regulation in living systems. We aim to develop analytical methods that allow simultaneous observation and evaluation of genetic and epigenetic information in individual cells. This understanding is particularly critical in fields such as cell-based drug screening and regenerative medicine, where cellular behavior cannot be interpreted solely through the lens of the genome.
To address this challenge, we launched a study on the determination of genetic and epigenetic control processes in cells, using microfabricated devices and single-cell analysis technologies. We established a single-cell microcultivation system that enables long-term observation and precise control of individual cells. This system allows us to isolate living cells from tissue without damaging them, and then cultivate and monitor them under strictly regulated conditions. Through the use of microchambers and microchips, we can manipulate factors such as cell density, spatial arrangement, and nutrient availability while tracking changes in gene expression at the single-molecule level. Techniques such as photothermal denaturation and high-resolution single-cell assays provide detailed insights into the molecular state of each cell.
This constructive approach is grounded in the idea that although genetic information defines the potential for biochemical reactions, the actual regulatory dynamics in living systems are shaped by environmental context—what we refer to as epigenetic information. In this framework, the cell is viewed not merely as a biochemical reactor, but as an intelligent information-processing unit capable of adapting to internal and external changes. By adopting this view, we can begin to reinterpret cellular processes in terms of information flow and decision-making, rather than relying exclusively on reaction-based models.
The strength of our approach lies in its ability to bypass the complexity of poorly understood reaction networks and focus instead on system-level behavior. It offers a conceptual bridge between molecular biology and systems physics, allowing us to explore phenomena such as variation among genetically identical cells, inheritance of non-genetic traits across generations, cellular adaptation to environmental changes, and the formation of spatial patterns in multicellular assemblies.
Through continued experimentation and observation, we aim to clarify the role of epigenetic information in cellular signaling and control. Ultimately, our goal is to construct a unified model of living systems that accounts for both genetic and epigenetic contributions, providing a foundation for interpreting and controlling complex cellular behaviors.

MESSAGE to STUDENTS
Live your life to the fullest by embracing challenges with all your strength. Find and pursue your one-and-only path that you will follow for a lifetime.
Education and Career
1990: Bachelor of Science, Department of Physics, School of Science and Engineering, Waseda University
1992: Master of Science, Department of Physics and Applied Physics, Graduate School of Science and Engineering, Waseda University
1992–1999: Researcher, Advanced Research Laboratory, Hitachi, Ltd.
1999–2006: Associate Professor / Professor, Graduate School of Arts and Sciences, The University of Tokyo
2006–2016: Professor, Institute of Biomaterials and Bioengineering, Tokyo Medical and Dental University
2016–Present: Professor, Department of Physics, Faculty of Advanced Science and Engineering, Waseda University
Professional Memberships
- Biophysical Society of Japan
- Physical Society of Japan
- Japan Society of Applied Physics
- Biophysical Society (USA)
- Acoustical Society of America

